蛋白质作为生命活动的直接参与者和执行者,是疾病治疗的重要靶点。小分子药物(通常分子量小于 1000 Da 的有机化合物)通过精细调节蛋白质活性、丰度和相互作用来发挥有效的治疗作用。常见的小分子药物包括天然产物及其衍生物(例如草药单体)以及化学合成药物。这些药物进入人体后,通过与细胞内或细胞外的靶蛋白结合而发挥治疗作用。因此,了解小分子药物如何与靶蛋白结合对于药物开发尤其重要,尤其是在活细胞、血液和患病组织等复杂的生理环境中。深入分析小分子药物与蛋白质之间的相互作用,不仅能够精确识别药物靶点,还能揭示药物作用的分子机制和潜在的脱靶效应。此外,它有望发现新的治疗靶点,从而为疾病治疗提供更丰富的策略。
除小分子药物外,生物体内源性小分子代谢物,如 ATP、胆固醇、胆汁酸、花生四烯酸和视黄酸,通过与蛋白质(包括转运蛋白、膜蛋白)相互作用,参与调节许多重要的信号通路和蛋白质活性。受体、转录因子和代谢酶。近年来,肠道微生物代谢物与宿主细胞之间的相互作用已成为研究热点。因此,深入研究和绘制细胞环境中代谢物和蛋白质之间的相互作用网络,特别是在疾病状态下,对于理解生命过程和治疗疾病具有重要意义。
化学蛋白质组学作为化学生物学的一个重要分支,目前已广泛应用于蛋白质功能研究、小分子药物靶点识别、新药结构筛选等领域。该技术平台利用多种功能多样的化学探针,结合蛋白质组学,旨在阐明生理条件(如活细胞、血液、组织等)下小分子与蛋白质之间的相互作用机制。值得一提的是,与纯化的蛋白质系统相比,利用活细胞系统是化学蛋白质组学的一大特点。它可以真实地描述复杂蛋白质组中小分子药物、内源代谢物等靶标的分布,甚至可以精确到氨基酸残基位点的水平。
Genlay 提供小分子-蛋白质相互作用的专业分析服务,使您能够更深入地研究潜在的药物靶点,增强您对药物分子机制和潜在副作用的理解。我们的专家团队在化学蛋白质组学研究方面拥有丰富的经验,将为您选择最合适、最可靠的方法,消除您对技术挑战的担忧,轻松促进您的研究进展。
1. 非共价小分子药物直接靶点的鉴定
在疾病药物研发领域,小分子药物无疑发挥着至关重要的作用。根据最近的统计,在 FDA 批准的药物靶向的 854 个人类蛋白质靶点中,惊人的 84% 对应于小分子药物。值得注意的是,其中只有 665 个靶标已通过小分子药物成功开发(来源:https://www. Proteinatlas.org/ humanproteome/tissue/druggable)。小分子药物可以通过非共价和共价机制与靶蛋白相互作用。小分子药物与靶蛋白之间的绝大多数相互作用以非共价方式发生,通过氢键、π-π堆积和疏水相互作用等机制与结合口袋中的氨基酸残基形成动态、可逆的相互作用。因此,从复杂的蛋白质组中稳定富集和分离非共价小分子药物结合的蛋白质是一项极具挑战性的任务。
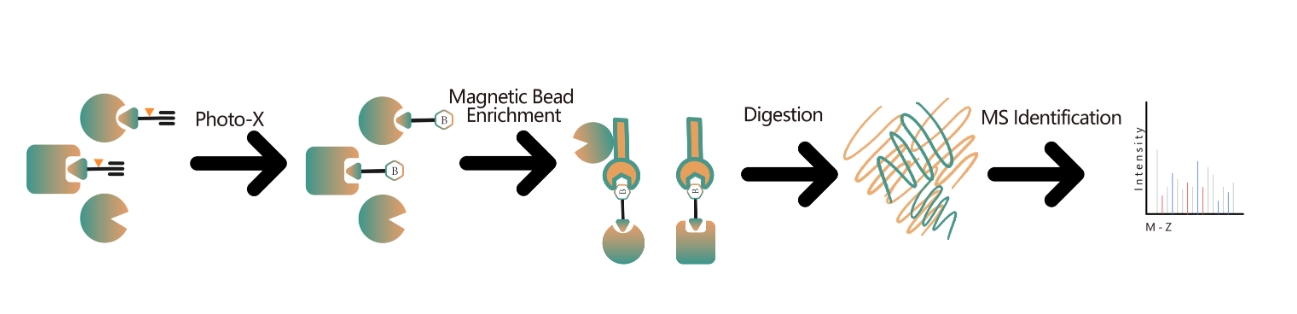
为了应对这一挑战,Genlay 开发了基于光探针的化学蛋白质组靶点识别技术平台。该平台准确捕获活细胞内小分子与蛋白质的动态结合并实现分离和富集,在蛋白质组水平上全面鉴定非共价小分子药物的直接靶点。
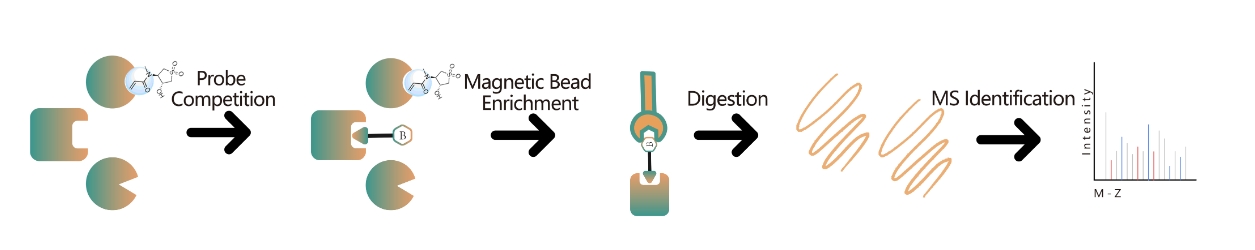
技术平台:基于光探针的化学蛋白质组靶标识别平台涉及探针设计、合成、活性评估、标记、蛋白质富集和数据分析等关键步骤。非共价小分子药物,包括合成物、草药化合物、天然物和代谢物,可以修饰成光反应探针。这些探针与细胞内的靶标结合后,形成稳定的共价相互作用,从而能够选择性富集和鉴定低丰度靶蛋白。结合各种实验设置,该方法提供了靶蛋白的全面定量、阐明机制、发现新靶点,并以更丰富的见解增强药物开发。
案例研究:在药物筛选过程中,利用细胞活性筛选技术,发现化合物A对靶细胞具有显着的抑制作用。为了进一步从分子水平鉴定其靶蛋白,破译其作用机制,探索潜在的新靶点,我公司根据化合物A的结构和活性特征,设计合成了光反应探针Probe A(结合光反应基团和生物正交基团)。利用化学蛋白质组学技术平台,我们采用荧光标记和质谱技术来鉴定与活性相关的细胞系中的目标蛋白。结合生物信息学分析方法,我们深入研究了化合物A及其相关新靶蛋白的作用机制。
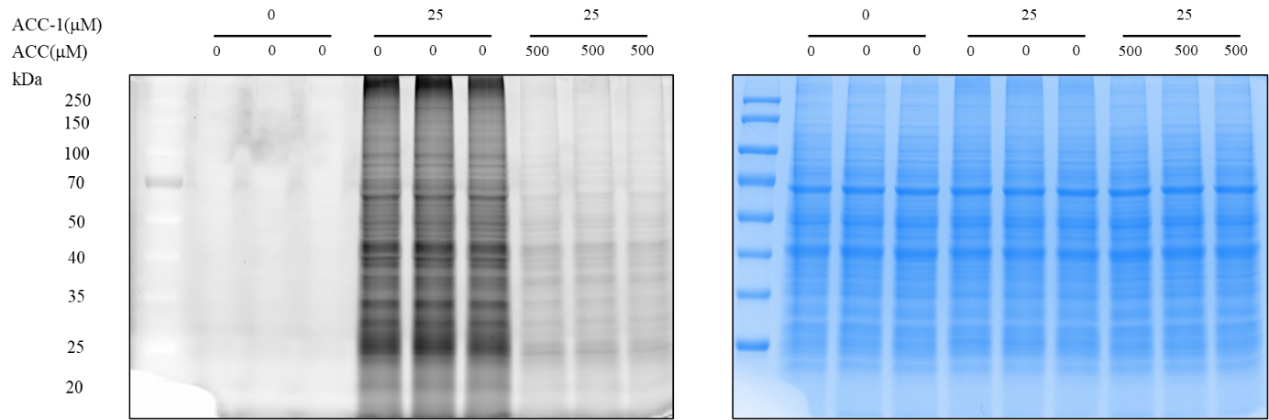
根据标记实验的荧光凝胶分析,探针A有效地标记了蛋白质,并且标记信号可以与化合物A显着竞争。这表明探针A具有与化合物A相似的目标覆盖率,使其成为合适的化学探针工具。后续目标发现。
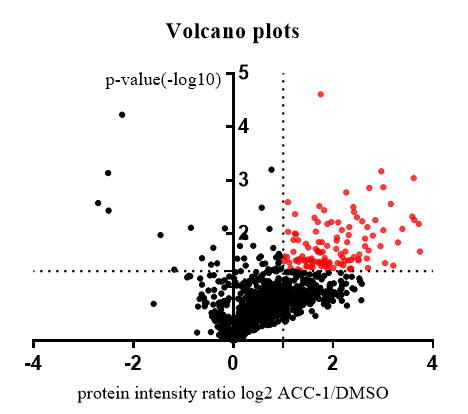
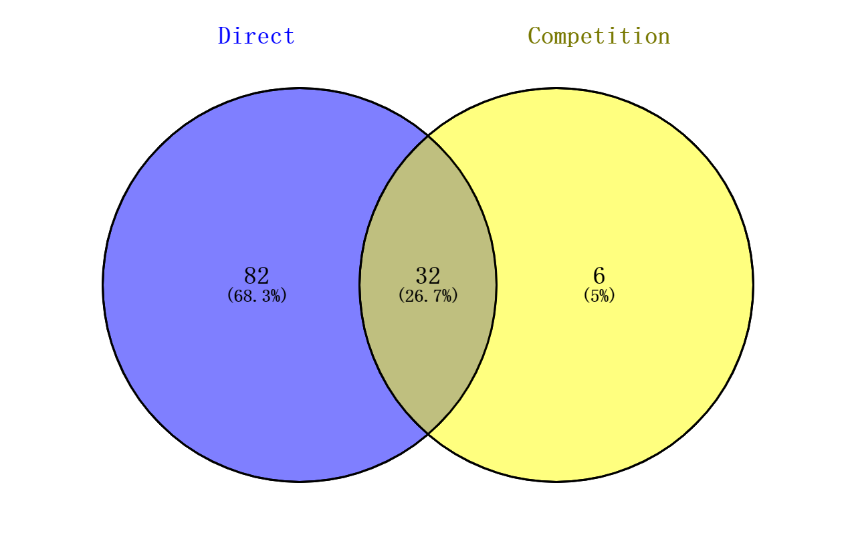
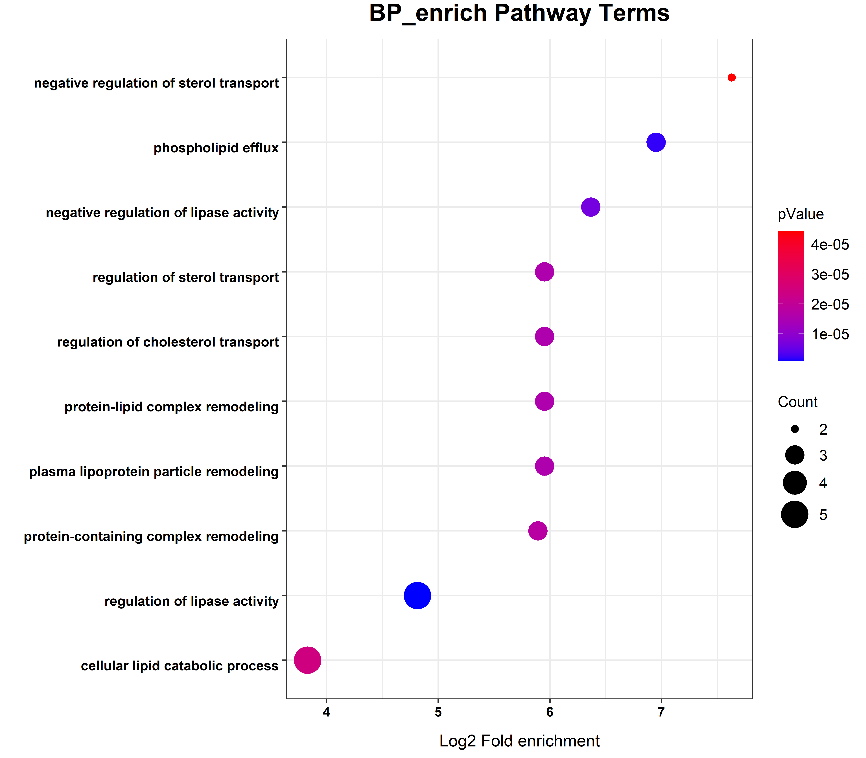
火山图展示了探针 A 与 DMSO(直接)实验的结果,其中探针 A 显着富集了 114 种蛋白质(在上图中以红色突出显示)。在探针 A 与(A+探针 A)(竞争)中实验中,38 个蛋白质(下图中以红色突出显示)被探针 A 标记,并与原始化合物 A 显着竞争。这两个实验生成了 32 个与化合物 A 结合具有高置信度的蛋白质(n = 3,比率 ≥ 2,p -值≤0.05)。对与化合物 A 结合的 32 种具有高置信度的蛋白质进行 GO 生物途径分析,结果显示信号传导途径显着富集,例如磷脂外流、脂肪酶活性的负调节和甾醇转运的调节,与表型一致。
2. 非共价小分子药物结合袋的鉴定
在小分子药物研发过程中,了解药物与靶蛋白的结合模式对于阐明药物作用机制、指导后续结构优化至关重要。 X 射线晶体学、冷冻电子显微镜 (cryo-EM) 和核磁共振 (NMR) 等结构生物学技术已成为确定药物结合模型的关键工具。特别是高分辨率的药物-蛋白质共晶结构极大地促进了药物结构的优化。
然而,蛋白质结构的阐明,特别是 GPCR 和离子通道等膜蛋白靶标的结构,一直是生命科学研究中的一项艰巨挑战。该过程涉及蛋白表达和纯化、药物蛋白结晶条件筛选、晶体数据收集和分析等多个步骤,不仅耗时而且成本高昂。
在细胞水平上,直接研究药物和靶蛋白之间的作用模式有助于避免纯化过程中蛋白质结构的变化以及人工缓冲系统和高药物蛋白浓度可能引起的假阳性结果。 Genlay 致力于提供一站式服务,利用先进技术解决确定小分子药物与细胞靶蛋白相互作用的挑战,为客户的药物研发提供强有力的技术支持。
技术平台:Genlay 利用生物活性光反应化学探针(具有与药物分子类似的活性)提供化学蛋白质组学服务。这些探针在生理相关药物浓度下与疾病相关细胞或组织一起孵育,然后采用原位快速光交联技术,将药物分子探针和蛋白质靶标之间的非共价相互作用转化为共价相互作用。随后,通过目标蛋白富集、酶消化释放未修饰的肽段、选择性富集药物分子探针修饰的肽段等步骤,结合生物分子的高分辨率质谱,可以快速确定肽序列信息。最后,利用分子对接工具快速获得药物与靶蛋白的结合模型,为后续药物化学研究提供有力支持。
案例研究:候选药物分子B的靶标是具有多个药物结合袋的多次跨膜蛋白。尽管多次尝试使用X射线和冷冻电镜等结构生物学方法,但仍无法获得药物分子与靶蛋白之间的结合模型。
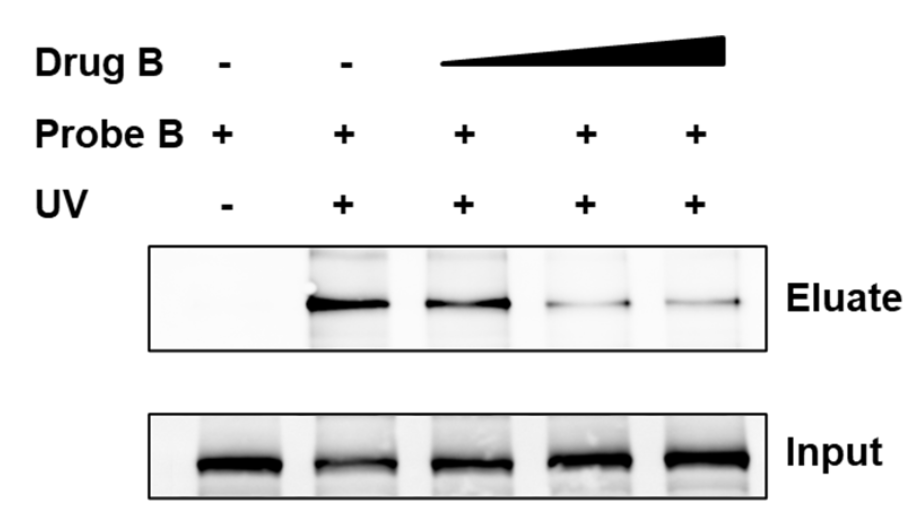
基于候选药物分子B的结构和活性,我公司设计合成了包含光反应基团和生物正交基团的光反应化学探针——探针B。利用上述化学蛋白质组学靶点发现平台,首先在与候选药物分子B活性相关的细胞系中验证靶蛋白。随后,利用基于质谱的非共价药物结合口袋识别技术,将空间相邻的肽段确定了药物结合袋,并提供了药物-蛋白质结合模型。
免疫印迹分析显示候选药物分子 B 有效地与细胞中的探针标记信号竞争,表明候选药物分子与靶蛋白之间直接结合。
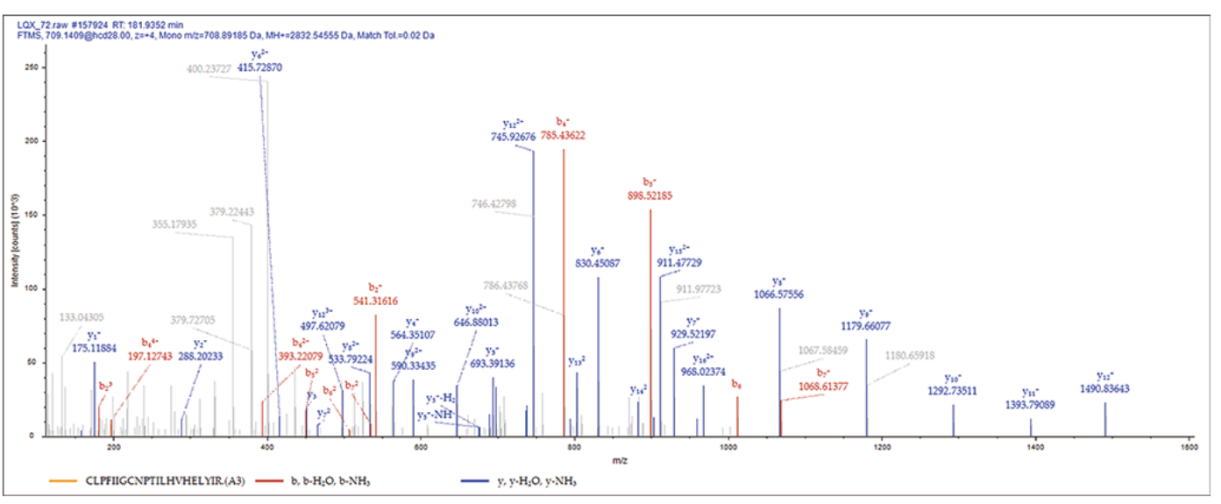
由于化学探针只能与空间接近的肽段交联,因此通过串联高分辨率质谱法鉴定了序列 CLPFIIGCNPTILHVHELYIR 以确定交联的肽段。
3. 共价小分子药物靶点的占有率和选择性的定量分析
共价药物主要通过与靶蛋白上的特定氨基酸残基(包括半胱氨酸、赖氨酸、丝氨酸等)形成共价键来发挥作用。阿司匹林是第一个被发现的共价药物分子,天然产物中存在几种具有抗炎生物活性的代表性共价药物,如青蒿素。近年来,共价靶向药物受到制药公司的广泛关注。目前,至少有六种靶向激酶靶点的共价药物已获得 FDA 批准,例如靶向 BTK 激酶的依鲁替尼。
发现细胞或组织中共价药物靶点的有效方法是通过引入报告基团(如生物素、生物正交基团等)对活性小分子进行化学修饰。在保留小分子原始活性的同时,这种修饰使我们能够直接捕获活细胞或组织中与之相互作用的蛋白质靶点。随后,通过富集、酶切、质谱鉴定和数据分析,可以获得靶标的组学信息和小分子作用的氨基酸残基信息。但在实际应用中,许多活性分子不易进行化学修饰,或者与氨基酸残基反应后产生的产物不稳定,不适合质谱检测。针对这些挑战,SciCorpBio提供了有效的解决方案——竞争位点识别。
技术平台:我们的技术平台以通用化学探针为中心。当活性小分子与氨基酸残基反应并占据结合位点时,与空白对照样品相比,这种通用化学探针会对该结合位点产生显着的信号差异。通过检测标记信号中的这些差异,我们可以准确地获得有关活性分子的靶蛋白和氨基酸残基的信息,包括预期的(在靶)和潜在的脱靶蛋白。该技术平台为共价药物的靶点发现和药物作用机制的研究提供了强有力的支持。
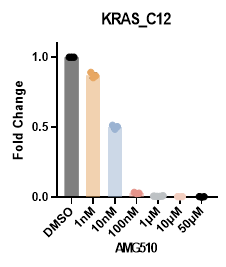
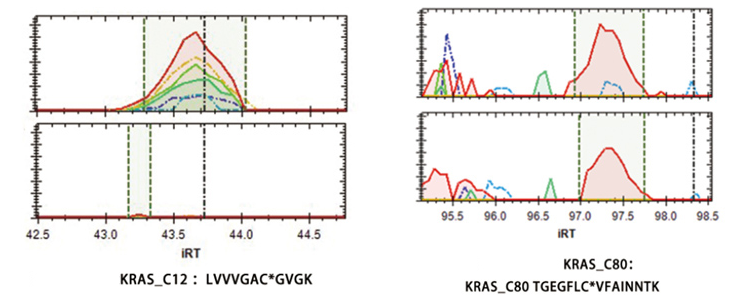
案例研究:AMG510是安进公司研发的全球首个针对KRAS-G12C突变肿瘤的靶向药物。该项目旨在验证其在相应突变细胞中的靶点特异性和选择性。利用Genlay 的DIA-ABPP平台,我们全面筛选了细胞中AMG510的共价靶标,直至氨基酸残基水平。
实验数据显示,在NCI-H358细胞上进行的四次重复实验中,系统分析了来自5,768个蛋白质的总共16,992个半胱氨酸残基。在1μM AMG510处理下,KRAS_C12位点出现显着变化,而KRAS_C80不受影响,这为AMG510对KRAS-G12C突变位点(标有星号表示目标半胱氨酸残基位点)的高特异性提供了有力的证据。
4. 蛋白质降解剂靶标的鉴定和选择性分析
近年来,靶向蛋白质降解(TPD)已成为一种创新的治疗策略,旨在通过使用药物分子干预蛋白质表达来调节疾病。在这些方法中,靶向嵌合体的蛋白水解(PROTAC)引起了人们的广泛关注。 PROTAC的概念最早由Crews等人提出。 2001年,其核心思想是利用内源性泛素-蛋白酶体系统降解靶蛋白,从而达到治疗目标。由于其高活性、能够靶向“不可成药”的蛋白质以及克服耐药性,PROTAC已成为药物开发的热点,辉瑞、拜耳、默克等各大制药公司积极参与该领域的研发。
除了 PROTAC 之外,还有几种类似的策略,包括利用泛素-蛋白酶体系统的分子胶降解剂、利用内体-溶酶体途径的溶酶体靶向嵌合体 (LYTAC),以及自噬靶向嵌合体 (AUTAC) 和自噬体束缚化合物 (ATTEC) )利用自噬-溶酶体途径。这些方法正在为疾病治疗的新途径铺平道路。
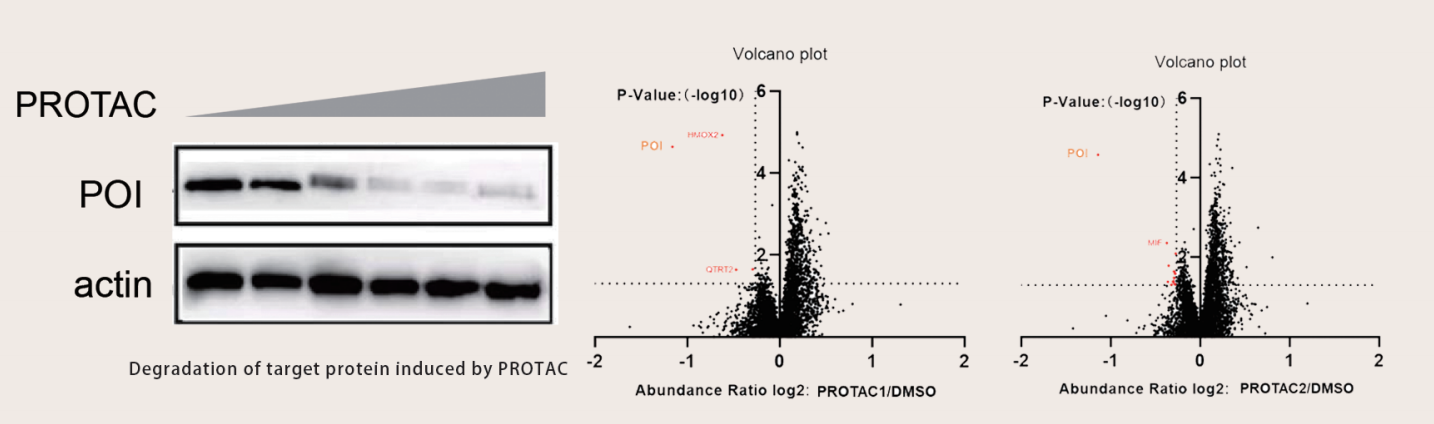
然而,开发此类分子的一个关键评估标准是它们是否能够特异性降解目标蛋白而不影响细胞中其他蛋白的丰度。为了实现这一目标,定量蛋白质组学技术发挥着至关重要的作用。该技术能够使用高分辨率质谱在蛋白质组水平上定量比较不同样品中相同蛋白质的丰度。目前,常用的定量蛋白质组学策略包括在肽样品制备过程中引入稳定同位素标记。在质谱检测过程中,由于同位素标记的质量不同,来自不同样品的具有相同氨基酸序列的肽表现出不同的质荷比。因此,同一肽序列共洗脱离子的比例可以定量反映同一蛋白质在不同样品中的丰度。该策略不仅提高了样品制备和质谱数据采集的效率,而且减少了样品间的实验误差,使结果更加稳定可靠。
技术平台:Genlay 开发了多种定量化学蛋白质组学技术平台。其创新平台能够对单个细胞系中的 5,000 多种蛋白质进行精确的定性和定量分析,为全面的目标选择性分析提供强大的支持。以基于Tandem Mass Tag(TMT)标记的多定量蛋白质组技术平台为例,该技术首先从经过蛋白质降解剂处理的细胞样本中提取整个蛋白质组,然后通过酶消化和多定量标记步骤进行处理,然后再进行多定量标记。被混合在一起。为了提高蛋白质组的覆盖深度,通常利用液相色谱对肽样品进行预分级,然后对每个肽样品进行质谱检测,从而深入分析样品之间的蛋白质丰度差异,阐明关键的靶标信息和选择性数据。该平台为蛋白质降解剂的开发和优化提供评估和指导。
案例研究:设计并合成两种PROTAC分子。需要分析靶标和脱靶蛋白以比较选择性。采用基于TMT的定量MS方法进行蛋白质组分析。对肿瘤细胞系中总共 5900 种蛋白质进行了定量,并确定了 PROTAC1 和 2 个分子的 ON 和 OFF 靶标(Orbitrap Exploris 480 质谱仪、TMT10plex 和通过 PD 2.5 进行数据分析)